Автор: М.Б. Генералов (Университет машиностроения Институт химического машиностроения им. Л.А. Костандова).
Опубликовано в журнале Химическая техника №6/2016
Общие сведения о криохимической технологии
При получении наночастиц и наноструктур различных материалов находят все более широкое применение методы криохимичекой технологии [1, 2]. В случае производства нанодисперсных порошков последовательно проводят технологические стадии формирования гомогенных эвтектических растворов, которые затем распыляют на капли в емкостных аппаратах с криогенной средой (например, в объеме жидкого азота) и быстро замораживают. На следующем этапе производства осуществляют совмещенные процессы сублимационного удаления растворителя из слоев замороженных твердых гранул и десублимацию растворителя. В результате получается продукт, состоящий из тончайших пористых гранул, обладающих сыпучими свойствами.
Дальнейшая их обработка зависит от назначения конечного продукта. В случае получения оксидов металлов, например, для ферритных композиций дополнительно проводят технологические операции дегидратизации и термического разложения, подготовки ферритных композиций (измельчение, классификация, смешение), формование под давлением и спекание ферритных изделий.
Стадия замораживания или криокристаллизация является наиболее ответственной во всем технологическом цикле. Технологические параметры проведения этой стадии предопределяют структуру и свойства конечного продукта. С повышением скорости замораживания размер образующихся структурных элементов твердой фазы уменьшается, а равномерность распределения компонентов возрастает. В зависимости от катионно-ионного состава растворенного вещества процесс кристаллизации может развиваться различными путями: с одновременной кристаллизацией всего раствора, с образованием кристаллов льда из части растворителя или с частичным или полным стеклованием раствора. Самоорганизация системы в монодисперсную структуру происходит при достижении скорости замораживания порядка 1 мм/с и темпе охлаждения не ниже порядка 102 К/с.
В результате теоретического решения задачи затвердевания жидкой сферы в бесконечном объеме криогенной жидкости (моделируемое задачей Стефана [3]) получены следующие уравнения для расчета скорости
W = R/tкр и времени tкр кристаллизации жидких капель:
 где R –усредненный радиус капель; ρ – плотность твердой эвтектики; qкр – теплота кристаллизации раствора;
где R –усредненный радиус капель; ρ – плотность твердой эвтектики; qкр – теплота кристаллизации раствора;
Bi = αR/λ; a – коэффициент теплоотдачи на поверхности глобулы (численные значения приведены в книге [3]); λ – коэффициент теплопроводности твердой эвтектики; Tэ, T
L –температура соответственно эвтектики раствора и охлаждающей среды (жидкого азота).
Сублимационное удаление растворителя из замороженных гранул проводят при давлении более низком, чем давление, соответствующее тройной точке растворителя. Это позволяет свести к минимуму агломерацию сформировавшихся на стадии замораживания частиц продукта, благодаря исключению появления в материале фрагментов капельной влаги.
Параметры тройной точки (температура, давление) зависят от свойств растворителя и растворенного вещества, а также от состава раствора. Например, для чистой воды эти параметры составляют давление (р = = 610 Па) и температура (Т = 0,0076°С).
На стадии сублимации теплоту, затрачиваемую на испарение льда, к продукту подводят кондуктивными методами или с использованием источников инфракрасного, электромагнитного и других видов излучения; в ряде случаев используют их комбинацию. Удельная теплота сублимации вещества qсуб примерно равна сумме их удельных теплот плавления qпл и испарения qисп.
Для воды величина qсуб достигает ~3 МДж/кг, а qпл составляет всего ~0,34 МДж/кг.
Процесс сублимации можно проводить в периодическом или непрерывном режиме. В промышленном производстве используют преимущественно установки периодического действия. Как правило, это связано с трудностями загрузки и выгрузки продуктов из аппаратов вакуумной техники.
Продолжительность процесса сублимации при подводе энергии через паропроницаемый слой замороженных гранул определяется следующим образом [3]:
 где tсуб – время полной сублимации; ϕл – массовая доля льда в гранулах; ρл – плотность льда растворителя;
где tсуб – время полной сублимации; ϕл – массовая доля льда в гранулах; ρл – плотность льда растворителя;
Н – толщина слоя гранул; λс – коэффициент теплопроводности высушенного слоя материала, Тн, Тап – температура соответственно теплоподводящей поверхности и равновесная давлению в сублимационной камере.
Лимитирующей стадией криохимичнской технологии является процесс сублимационной сушки, продолжительность которого для многих продуктов по расчетным и практическим данными составляет ~10 ч.
Для поддержания движущейся силы в процессе сублимационной сушки необходимо обеспечить отвод паров растворителя из сушильной камере. Среднее значение плотности потока пара растворителя в процессе сублимации слоя гранул

Поскольку процесс сублимации осуществляют при достаточно высоком вакууме (остаточное давление порядка 50…150 Па) и температуре от –20 до –50°С, в этих условиях происходит твердофазная конденсация (десублимация) паров растворителя. Такой процесс десублимации проводят с использованием как поверхностных, так и контактных конденсаторов холодильной техники.
Получаемый после сублимационной сушки продукт представляет собой пористые гранулы размером 1…4 мм, состоящие из равномерной смеси ультраили нанодисперсных твердых частичек, которые скреплены по зонам контакта хрупкими «кристаллическими мостиками» (рис. 1). При незначительном механическом воздействии гранулы разрушаются, и образуется порошок, характерный размер частиц которого по порядку величины равен характерному размеру кристаллитов, сформировавшихся на стадии замораживания из растворенных веществ. В этих материалах исключительно высокая равномерность распределения компонентов сочетается с большой удельной поверхностью (5…15 м2/г).

а – общий вид; б – структура гранул
В зависимости от назначения продукта пористые гранулы подвергают дальнейшей обработке (термической, механической, химической) или используют непосредственно, преимущественно в быстропротекающих гетерогенных процессах.
Из материалов криохимического синтеза в химической промышленности изготовляют фильтры, катализаторы, адсорбенты с развитой внутренней поверхностью.
В целом ряде случаев их используют в традиционных процессах керамической технологии при термическом разложении солей до оксидов, приготовлении ферритов, высокотемпературных сверхпроводников, полимерных композиций и др.
Свойства и особенности продуктов криохимического синтеза различных материалов приведены на рис. 2.
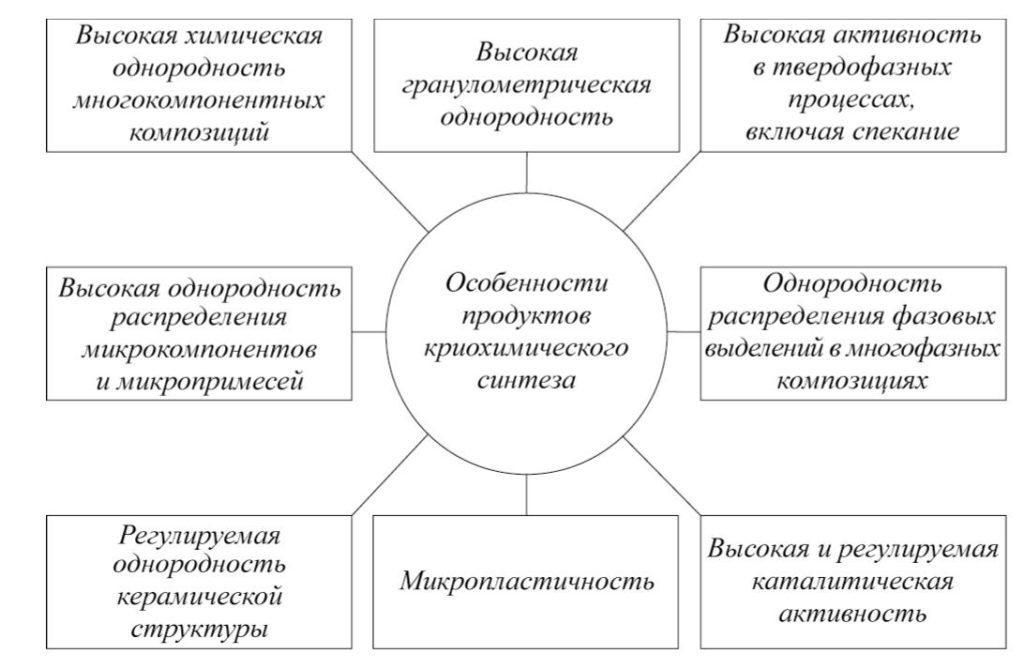
Структура продуктов криохимического синтеза
Возникновение кристаллов в каплях гомогенного раствора является результатом двух элементарных процессов: первоначального возникновения способного к росту зародыша и дальнейшего его роста до превращения в кристаллит.
Кристаллизацию капель растворов в криохимических способах замораживания осуществляют с очень большими скоростями охлаждения. По этой причине результаты известных теоретических и опытных данных [4], касающиеся кинетики и структурообразования новой фазы, не могут быть использованы в полном объеме при кристаллизации фрагментов растворов в криогенных жидкостях.
Основными факторами, определяющими структуру твердых гранул, образовавшихся в процессе криокристаллизации капель раствора определенного химического состава, являются скорость охлаждения, размер капли, скорости зарождения и роста кристаллов. Если скорость охлаждения очень большая, а количество жидкости в каплях сравнительно мало, то возникающая твердая фаза вещества наиболее вероятно образует множество равноосных кристаллитов, размеры которых в значительной степени определяются степенью переохлаждения или соответствующего пересыщения раствора. Указанные особенности процесса криокристаллизации растворов необходимо учитывать при разработке теоретических методов расчета кинетики роста и окончательных размеров образующихся кристаллитов.
В начале процесса отверждения жидких глобул бинарных эвтектических растворов и зарождение центров кристаллизации происходит у ее поверхности, где осуществляется интенсивный перенос теплоты в окружающий объем криогенной жидкости и образуется единый фронт фазового превращения. Расширение зоны твердой фазы вглубь глобулы осуществляется по закономерностям последовательной спонтанной кристаллизации. Перед образовавшимся фронтом твердой фазы возникает пограничный гетерогенный двухфазный слой, состоящий из переохлажденного раствора и твердой фазы возникающих кристаллитов.
Проведенные исследования [4] показали, что затвердевание капель эвтектических растворов солей при высоком темпе их охлаждения происходит за счет образования «эвтектических колоний», в которых совместный рост обеих фаз протекает с большой скоростью.
После образования зародыша вокруг растущего кристаллита целевого продукта образуется диффузионный слой раствора («дворик кристаллизации»). В нем возникает градиент концентраций, обусловленный пересыщением раствора в метастабильном состоянии, от концентраций насыщения в переохлажденном растворе С0 на поверхности кристалла до исходной эвтектической концентрации Сэ на границе диффузионного дворика.
Размер таких диффузионных двориков соизмерим с размерами образующихся кристаллитов целевого продукта.
Например, по данным монографии [3], при кристаллизации капель радиусом Rк ≈ 0,5…1,5 мм эвтектического водного раствора калия нитрата в жидком азоте абсолютное переохлаждение относительно равновесной температуры эвтектики ΔТ ≈ 10…15 К, а коэффициент пересыщения γ = Сэ/С0 ≈ 1,30…1,57. При этих условиях раствор имеет более высокую вязкость, чем при температуре равновесной эвтектики, и процесс кристаллизации наиболее вероятно контролируется диффузией в жидкой фазе.
Возникновение в растворе зародыша кристалла (размер rкр) и работа его образования Аз подчиняются общим закономерностям кинетики нуклеации в конденсированной фазе и определяются следующими выражениями [5]:
rкр = 2σMт/(ρRTγ);
Аз = 4π(rкр)2σ/3, (4)
где σ – поверхностная межфазная энергия на границе кристалл-жидкость; Мт – молекулярная масса вещества кристалла; ρ – плотность кристалла; R = 8,3 Дж/( моль⋅К) – молярная газовая постоянная.
Зародыши, радиус которых меньше rкр, нестабильны и вновь переходят в раствор.
Проведенный анализ кинетики гомогенной нуклеации бинарных растворов показал, что в любой метастабильной системе должно произойти флуктуационное преодоление энергетического барьера нуклеации, равного работе образования критического зародыша Аз. Вероятность таких флуктуаций подчиняется статистическому распределению Больцмана. В результате скорость стационарного изотермического образования центров кристаллизации в жидкой фазе в единице объема и в единицу времени определяется в следующем виде [3]:
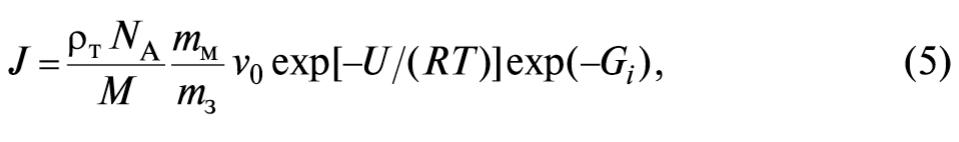 где NA = 6,02⋅1023 моль–1 – постоянная Авогадро; mм, mз – соответственно масса молекулы вещества кристалла и зародыша; ν0 = 1/t0; t0 – время колебаний частиц (молекул, атомов, ионов) растворенного вещества около положения равновесия (для водных растворов солей n0 ~ 1012 с–1); U – энергия активации диффузии молекул в растворе, предопределяющая скорость перехода молекул из раствора в зародыш растворенного вещества (для водных растворов солей при переохлаждении порядка 10К U ≈ (2…2,5)104 Дж/моль); Gi = Аз/(kT) – безразмерное число Гиббса; k = 1,38⋅10 –23 Дж/К – постоянная Больцмана.
где NA = 6,02⋅1023 моль–1 – постоянная Авогадро; mм, mз – соответственно масса молекулы вещества кристалла и зародыша; ν0 = 1/t0; t0 – время колебаний частиц (молекул, атомов, ионов) растворенного вещества около положения равновесия (для водных растворов солей n0 ~ 1012 с–1); U – энергия активации диффузии молекул в растворе, предопределяющая скорость перехода молекул из раствора в зародыш растворенного вещества (для водных растворов солей при переохлаждении порядка 10К U ≈ (2…2,5)104 Дж/моль); Gi = Аз/(kT) – безразмерное число Гиббса; k = 1,38⋅10 –23 Дж/К – постоянная Больцмана.
После образования зародыша вокруг него образуется диффузионный дворик. В предположении, что этот дворик и растущий кристаллит имеют шаровую симметрию, пусть δ(t) будет радиус растущего кристаллита, увеличивающийся со временем t.
На поверхности диффузионного дворика при r = Rкр концентрация раствора равняется сходной эвтектической долевой концентрации Сэ; на поверхности кристаллита при r = δ(t) долевая концентрация раствора С0 = = Сэ – ΔС (здесь ΔС – пересыщение раствора, при этом δ(t) ≤ r ≤ Rкр).
В предположении, что процесс кристаллизации эвтектического бинарного раствора осуществляется при постоянной концентрации насыщения на поверхности кристаллита; значения теплофизических параметров в объеме диффузионного дворика не изменяются на протяжении всего процесса кристаллизации, и существует монодисперсное распределение размеров зародышей и растущих кристаллитов, средний объем кристаллитов образующейся твердой фазы Vк с учетом уравнения (5) можно оценить с помощью следующего выражения:
Vк = (π/3)0,25(W/J)0,75. (6)
Тогда радиус образовавшихся кристаллитов
Rкр ∼ (W/J)1/4. (7)
Рассчитанные по формулам (1), (5) и (7) значения диаметра d = 2Rкр образующихся кристаллитов при замораживании в жидком азоте капель водных эвтектик калия нитрата размером R = 0,5…1,5 мм при пересыщении раствора γ = 1,57…1,30 представлены в табл. 1.
Таблица 1
Диаметр кристаллитов
| Размер | g = Сэ/С0 | ||
| 1,30 | 1,37 | 1,57 | |
| Rк, мм | 1,5 | 1,0 | 0,5 |
| d, нм | 320 | 96 | 32 |
Результаты теоретических расчетов сопоставляли с экспериментальными данными работы [6] по определению дисперсных характеристик гранул, полученных из капель водных эвтектик KNO3 по криохимической технологии. В начале единичные капли раствора диаметром 1…3 мм замораживали в жидком азоте. Затем из гранул удаляли водный лед при вакуум-сублимационной сушке (электронную фотографию структуры см. рис. 1).
У высушенных пористых гранул определяли средний размер и дисперсный состав частиц. На рис. 3 показана диаграмма функции f(d) распределения частиц по размерам относительно общего количества частиц порошка калия нитрата, построенная по результатам диффузионной аэрозольной спектрометрии на приборе ДАС 2702 работы [6]; средний размер частиц составляет 140 нм.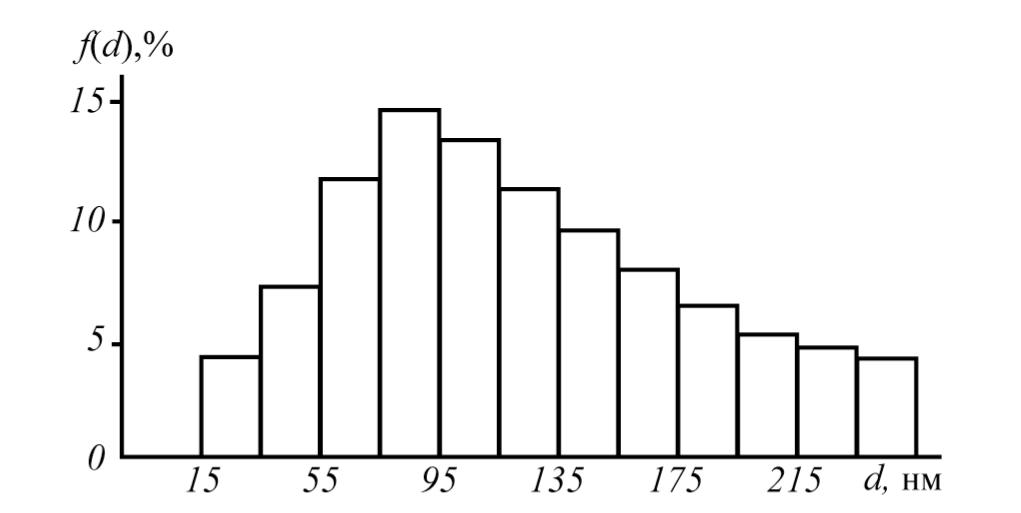
Как видно из приведенных данных, имеется удовлетворительное соответствие между расчетными и экспериментальными значениями по порядку размеров образующихся кристаллитов нанодисперсного порошка калия нитрата.
Проведенные рентгеноскопический и зондовый электронный микроскопический анализ внутренней структуры гранул позволили выявить морфологические и структурные особенности гранул. Гранулы состоят из отдельных дисперсных фрагментов (частиц) размером от 20 до 200 нм, соединенных между собой в зонах контакта ионными кристаллизационными мостиками, которые легко разрушаются в случае последующей переработке пористых гранул.
Сравнительные данные по гранулометрическому составу, удельной поверхности и насыпной плотности обычных и нанодисперсных порошков калия нитрата представлены в табл. 2.
Таблица 2
Физико-механические характеристики различных форм КNO3
| Материал | Плотность, кг/м3 | Удельная площадь поверхности, м2/г | Гранулометрический состав, мкм | |||
| Насыпная | Монокристалла | Rcр | Rmax | Rmin | ||
| Исходный КNO3 | 903 | 2200 | 0,10 | 70 | 125 | 7,7 |
| Наночастицы КNO3 | 110 | 2200 | 25,0 | 0,06 | 0,10 | 0,01 |
Следует отметить, что при выводе уравнений (5), (6) и (7) предполагался беспрепятственный рост кристаллитов новой фазы, что, конечно, не имеет места, за исключением сильно разбавленных растворов. Следует также отметить, что предложенный механизм структурообразования при кристаллизации эвтектических бинарных растворов солей в криогенных жидкостях и теоретические зависимости для расчетов характерных размеров частиц в образующихся нанодисперрсных порошках, естественно, нуждаются в дальнейшей проверке и уточнении. Полученные результаты проведенных исследований могут быть рекомендованы только для приближенного практического использования в криохимической технологии получения наноматериалов
Проведенные совместные научные исследования и опытно-промышленные испытания в Институте химического машиностроения и ряде отраслевых организаций показали, что методы криохимической нанотехнологии позволяют получать высокодисперсные порошки неорганических солей с новыми и улучшенными свойствами при строгом сохранении их химической природы.
Процесс получения наноматериалов осуществляется с использованием простого по конструкции оборудования и без вредного воздействия на окружающую среду.
Образующиеся пористые гранулы с ультраи нанодисперсной структурой соответствуют принятым нормам хранения и транспортировки сыпучих материалов.
Список литературы
- Гусев А.И. Наноматериалы, наноструктуры, нанотехнологии. М.: Физматлит, 2005.
- Генералов М.Б. Криохимическая нанотехнология. М.: Академкнига, 2006.
- Генералов М.Б. Основные процессы криохимической нанотехнологии. СПб.: Профессия, 2010.
- Бражников С.М., Генералов М.Б., Трутнев Н.С. Вакуумсублимационный способ получения ультрадисперсных порошков неорганических солей//Химическое и нефтегазовое машиностроение. 2004. №12.
- Кидяро Б.И. Кинетика образования кристаллов из жидкой фазы. Новосибирск: Наука, 1979.
- Трутнев Н.С., Буздалина И.А., Закревский В.А., Вихров К.А. Интенсификация процесса замораживания капель водных растворов в криохимической технологии//Химическое и нефтегазовое машиностроение. 2012. №2.









