Авторы: И.П. Семенов, В.А. Меньщиков, Б.Ю. Малышкин, Д.С. Сазонов (ООО United Catalyst Technologies)
Опубликовано на портале «Химическая техника», май 2020
При производстве фенола через изопропилбензол в качестве продукта образуется и ацетон, реализация которого в последнее время затруднена. При этом производство изопропилбензола требует в качестве реагентов бензол и пропилен. Авторами обобщаются литературные и собственные экспериментальные данные по способу исключения потребности в пропилене для производства фенола, а именно: предложено реализовать технологическую цепочку Ацетон→Изопропанол→Пропилен с использование промышленных катализаторов. Такой подход позволит при производстве фенола исключить потребность в привозном пропилене, что является выгодным решением для предприятий, которые не располагают собственным источником пропилена.
Производство фенола является многотоннажным. Его выработка в мире составляет 10 млн т в год, в России ежегодно вырабатывается 225 тыс. т. Фенол используется для получения дифенилолпропана, фенол-формальдегидных смол, алкилфенолов, красителей [1, 2].
Существует несколько технологий производства фенола:
- через сульфирование бензола и щелочное плавление бензолсульфокислоты;
- прямое окисление бензола до фенола;
- алкилирование бензола пропиленом до изопропилбензола, окисление последнего в гидроперекись и разложение на фенол и ацетон.
Первые две технологии в настоящее время практически не используются.
Если на заводе вместе с производством фенола имеется производство этилена пиролизом углеводородов С3 и более тяжелых, то одновременно с этиленом образуется и пропилен. В этом случае дефицита пропилена для производства фенола обычно нет. Однако, если этиленовых установок нет, то пропилен приходится получать со стороны в виде концентрированного потока или в виде пропан-пропиленовой фракции. В последнем случае требуется узел концентрирования пропилена. Стандартная технология производства фенола показана на рис. 1.
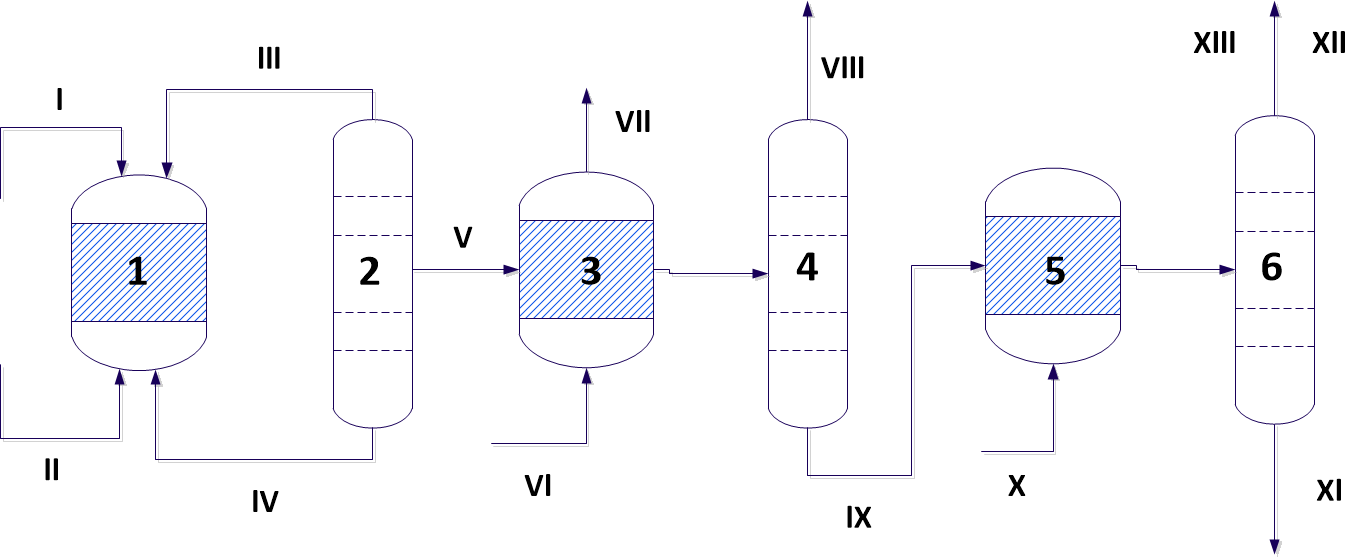
1 – алкилирование бензола пропиленом; 2 – выделение изопропилбензола; 3 – окисление ИПБ; 4 – выделение гидроперекиси ИПБ; 5 – разложение ГП ИПБ; 6 – выделение товарных продуктов – фенола и ацетона;
I – пропилен ; II – бензол; III – ДИПБ; IV – бензол; V – ИПБ; VI – воздух; VII – абгазы; VIII – побочные продукты; IX – ГП ИПБ; Х – серная кислота; XI – ацетон; XII- фенол; XIII – побочные продукты
Ацетон в производстве фенола является фактически побочным продуктом, так как не находит путей квалифицированного использования, и поэтому цена на него достаточно низкая (около 40 тыс. руб. за 1 т), а с реализацией часто возникают трудности.
Исследования показывают [3–4], что ацетон может быть прогидрирован в изопропиловый спирт (ИПС) с высокой конверсией и селективностью по следующей реакции:
СН3С(О)СН3 + Н2 → СН3С(ОН)СН3. (1)
В табл. 1 показаны некоторые результаты экспериментов гидрирования ацетона, проведенных в нашей лаборатории. Процесс протекает при давлении 1 МПа, температуре 100…130°С и объемной скорости 1,0…1,2 1/ч по жидкой фазе в присутствии отечественного катализатора на основе Cu-Zn. Из табл. 1 следует, что конверсия ацетона составляет 97–98 % при селективности его превращения в ИПС 95 %. ИПС используется как растворитель, в парфюмерии, в производстве перекиси водорода. Однако, если превращать весь ацетон, вырабатываемый в производстве фенола, в ИПС, то такое количество ИПС не найдет потребления.
Таблица 1
Результаты гидрирования ацетона
| Режим | Температура, оС | Давление, МПа | Объемный расход, м3/м3катал./ч | Селективность образования ИПС, % |
| 1 | 130 | 1.0 | 1.2 | 99,1 |
| 2 | 105 | 1.0 | 1.0 | 99,5 |
Применительно к производству фенола ИПС может быть дегидратирован в пропилен [5–6], который будет подан в узел алкилирования бензола:
СН3С(ОН)СН3 → Н3С=СН-СН3 + Н2О. (2)
Таким образом, отпадает потребность в пропилене за исключением компенсации потерь при алкилировании бензола, гидрировании ацетона и дегидратации ИПС, которые суммарно составляют 3–5 %. Вместо пропилена для покрытия его небаланса можно использовать соответствующую долю ацетона, который более доступен, чем пропилен.
Синтез изопропилового спирта по реакции (2) проводится в присутствии катализатора на основе окиси алюминия. В табл. 2 приведены некоторые результаты дегидратации ИПС, полученные в нашей лаборатории.
Таблица 2
Результаты дегидратации ИПС в пропилен
| Режим | Температура, оС | Давление, МПа | Объемный расход, м3/м3катал./ч | Конверсия ИПС, % | Селективность по пропилену, % мас. | Концентрация пропилена, % мас. | |
| 1 | 287 | 0,1 | 5,0 | 18 | 95,9 | 99,95 | |
| 2 | 302 | 0,1 | 5,5 | 52,5 | 98,65 | 99,92 | |
| 3 | 320 | 0,1 | 4,75 | 97,75 | 99,74 | 99,90 | |
| 4 | 327 | 0,1 | 5,25 | 99,75 | 99,63 | 99,94 | |
Из представленных данных следует, что при температуре 330 °С конверсия изопропилового спирта превышает 99 % при селективности превращения в пропилен 99,6 %. При этом концентрация образовавшегося пропилена выше 99,9 % (без учета паров воды).
Для гидрирования ацетона необходим водород, который может быть получен различными методами. Наиболее подходящими является электролиз воды или каталитический риформинг метанола в присутствии промышленных катализаторов синтеза метанола [7–9].
Электролиз является более простым способом, но требует больших затрат электроэнергии. Каталитический риформинг метанола требует больших капитальных затрат, но он менее затратен с точки зрения электропотребления. На один моль метанола можно получить три моля водорода по реакции
СН3ОН + Н2О → СО2 + 3Н2.
В табл. 3 приведены некоторые результаты наших исследований риформинга водного метанола. Процесс проводился при атмосферном давлении в присутствии катализатора на основе оксида алюминия меди и цинка.
Таблица 3
Риформинг водного метанола
| Температура, оС | Концентрация метанола, % мас. | Объемный расход, м3/м3катал./час | Конверсия , % | Концентрация водорода, % об. | |
| Метанол | Вода | ||||
| 300 | 100 | 2,5 | 73 | – | 64 |
| 300 | 50 | 4,9 | 63 | 40 | 69 |
| 310 | 50 | 2,6 | 88 | 37 | 70 |
| 325 | 50 | 1,8 | 96 | 40 | 73 |
| 325 | 75 | 1,7 | 87 | 70 | 74 |
Блок-схема такого процесса показана на рис. 2.
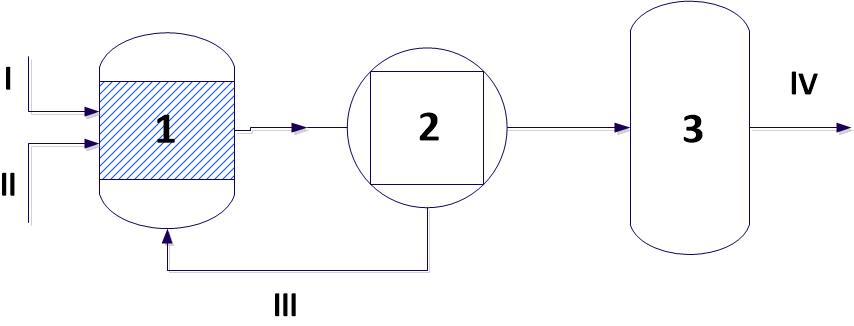
1 – узел конверсии воды и метанола; 2 – узел компримирования водорода; 3 – узел очистки и выделения водорода;
I – метанол; II – вода; III – рецикл воды и метанола; IV – водород
При риформинге чистого метанола основной примесью в водороде является оксид углерода, а при использовании водного метанола – диоксид углерода. Для гидрирования ацетона возможно использование 70 %-ного водорода, но показатели процесса и влияние примесей в нем требуют дополнительной проверки.
В результате проведенных исследований можно утверждать, что технология получения фенола через изопропилбензол может быть полностью независима от стороннего источника пропилена, а на основе отечественных промышленных катализаторов может быть создана технологическая цепочка Ацетон→Изопропанол→Пропилен для обеспечения производства фенола собственным пропиленом.
Список литературы
- Кружалов Б.А., Сергеев Б.И. Совместное получение фенола и ацетона. Госхимиздат, 1963.
- Kirk-Othmer. Encyclopedia of Chemical Technology. Phenol. Fourth edishion, V. 18. P. 288, 2010.
- Макарова О.В. и др. Характер взаимодействия водорода с оксидными медьсодержащими катализаторами: взаимодействие восстановленных хромита меди и оксида меди-цинка с ацетоном и оксидом углерода//Кинетика и катализ. Т. 35. № 3. 1994.
- Yurieva T.M. Mechanizm for activation of hydrogen and hydrogenation of acetone to isopropanole and carbon oxides to methanol over copper containing oxide catalysts//Catalysis Today. 1999/ V. 51. № 3-4. P. 457.
- Larsen G. Alcohol dehydration reactions over tungstated zirconia catalysts// Journal of Catalysis. 1997. V. 169. P. 67.
- Ontray T. Acidity, surface structure and catalytic performance of WOx supported on monoclinic zirconia// Journal of Physical Chemistry. 2005. V. 109. 8. P. 3345.
- Лукьянчиков В.С., Стреженский А.И. Паровая конверсия метанола, Киев: Наукова думка, 1972.
- Материалы фирмы Mahler AGS, mahler-ags/ru/hp/hydroform-m.
- Лыткина А.А. Паровой риформинг метанола с использованием катализаторов на углеродных и оксидных носителях. Дисс. … канд. техн. наук. М.: ИНХС, 2017









![Технологические аспекты получения уксусной кислоты Технологическая схема синтеза уксусной кислоты карбонилированием метанола: 1 – колонна синтеза; 2, 3 – сепараторы высокого и низкого давлений; 4…6 – ректификационные колонны; I – метанол + + катализатор; II – оксид углерода; III – продукты синтеза; IV – отработанный газ; V – раствор катализатора; VI – метанол; VII – уксусная кислота-сырец; VIII – товарная уксусная кислота; IX – кубовый остаток на сжигание [4]](https://chemtech.ru/wp-content/uploads/2018/10/afanasiev1_fmt-324x160.jpg)